干旱、高盐、低温等不良环境导致渗透胁迫,严重影响植物的生长发育。长期进化过程中,植物形成了复杂的渗透胁迫感知和响应机制,包括植物激素脱落酸(Abscisic acid,ABA)依赖与非依赖的信号途径等。其中RAF-SnRK2激酶级联途径在植物渗透胁迫感受和响应过程中有核心作用。拟南芥B-RAF家族包含B1-B4四个亚族(共22个成员),其中B1/B2/B3亚组RAF是ABA信号中的核心组分,与ABA受体PYR1/PYL/RCAR蛋白,A亚组(Clade A)磷酸酶PP2C,蛋白激酶SnRK2组成了ABA受体偶联核心通路。在非胁迫条件下,PP2C去磷酸化并抑制SnRK2的活性。当胁迫诱导植物体内ABA的产生和积累时,ABA与受体PYR1/PYLs/RCARs蛋白形成复合体,结合并抑制PP2C磷酸酶。蛋白激酶SnRK2.2/2.3/2.6从被抑制的状态下释放出来,被B1/B2/B3亚组的RAF蛋白激酶磷酸化并激活。激活的SnRK2通过磷酸化下游转录因子和离子通道等效应蛋白,介导植物渗透胁迫响应。有趣的是,与渗透胁迫强烈激活B2/B3亚组RAF蛋白激酶不同,ABA处理并不明显激活B2/B3 RAF蛋白激酶。但B2/B3 RAF的基础活性对SnRK2s的激活是必需的。B2/B3 RAF多重突变体OK100-nonu,与ABA受体多突变体、snrk2.2/2.3/2.6三突变体类似,对ABA处理不敏感。OK100-nonu在极高浓度的ABA (25 µM)处理下依然可以正常萌发并生长。因此,B2/B3 RAF激酶本底活性维持对于ABA途径是必需,但其中的分子机制并不清楚。
2025年8月8日,南方科技大学前沿生物技术研究院王鹏程教授团队在JIPB在线发表了题为 “Maintaining Basal B-RAF Kinase Activity for ABA Signaling via Reciprocal Phosphoregulation of a Single Serine Residue” 的研究论文,报道了ABA信号通路中单个氨基酸的磷酸化状态的转变维持B-RAF激酶本底活性的分子机制,为理解植物响应环境胁迫的机理提供了重要线索。
王鹏程教授团队利用邻近标记技术解析了PP2C家族成员ABI1潜在的互作蛋白,发现并验证了ABI1与RAF蛋白激酶存在直接的相互作用。有趣的是,与近期发表的RAF12相关研究结果不同,B2和B3亚组的多个成员如RAF3、RAF10等并不能磷酸化PP2C。与去磷酸化并抑制SnRK2.6(OST1)不同,ABI1等PP2C磷酸酶在体外能够显著增强RAF3、RAF4、RAF5、RAF10、RAF11等激酶结构域的自磷酸化活性,显示多个B2/B3 RAF蛋白是A亚组PP2C的直接底物。
进一步的定量磷酸化蛋白组学发现ABI1特异地靶向RAF3蛋白一个保守的丝氨酸残基(Ser619)。这一位点的模拟磷酸化突变体RAF3S619D在体外活性减弱,原生质体瞬时表达结果也显示该位点的磷酸化导致多个RAF家族成员活性下降。生物化学研究结果显示,Ser619为RAF3蛋白ATP结合的关键位点,该位点的的磷酸化会导致RAF3S619D完全失去ATP结合能力和激酶活性。进一步的研究显示Ser619是RAF3激酶的自磷酸化位点,RAF3通过该位点的自磷酸化抑制自身的激酶活性。
研究团队在OK100-B3突变体背景下进一步验证了这一位点的生物学功能。发现RAF3S619D无法恢复B3-RAF多重突变体ABA不敏感表型,且模拟去磷酸化的RAF3S619A植物表现出ABA超敏感表型。证实了该位点的磷酸化状态对RAF活性状态调节的重要作用。
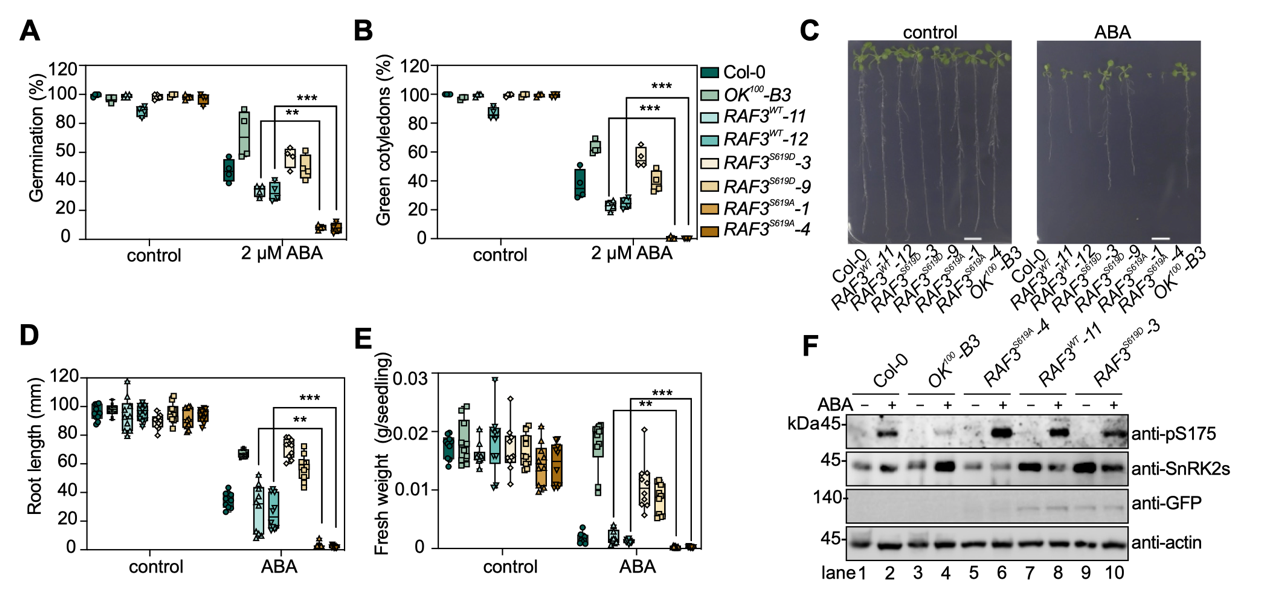
图1 RAF3 Ser619的磷酸化消除体内RAF3活性
通过上述结果,研究团队提出了植物通过PP2C介导的去磷酸化与B2/B3亚组RAF这一保守丝氨酸的磷酸化状态,精密调控ABA信号转导不同阶段RAF3活性的分子机制:在正常生长条件下,PP2Cs去磷酸化并抑制SnRK2,防止其激活。同时,ABI1去磷酸化RAF3的第619位丝氨酸,维持其ATP结合能力,RAF3结合ATP并维持本底的激酶活性,处于“预备”("Ready")状态。当环境胁迫诱导ABA的产生和积累时,ABA受体复合物结合并抑制PP2C,将SnRK2从PP2C介导的抑制中释放出来。随后,活化的RAF3将磷酸基团转移至SnRK2,启动SnRK2的自磷酸化(“就绪/Set”阶段)。随后,SnRK2通过分子间互磷酸化放大激酶激活效应,磷酸化下游效应器以启动ABA信号传导(“启动/Go”阶段)。此时,活化的RAF3可以结合ATP,并通过自磷酸化Ser619位点,抑制自身激酶的活性。当胁迫消退时,重新激活的PP2C会移除RAF3蛋白619位丝氨酸的磷酸基团,使去磷酸化的RAF3恢复ATP结合能力,从而“重置”("Reset")到活性状态,以响应可能的下一轮胁迫。ABA受体偶联的核心信号通路中的这一精妙分子机制,确保了B2/B3 RAF本底激酶活性的维持,以快速准确的响应ABA或环境挑战。
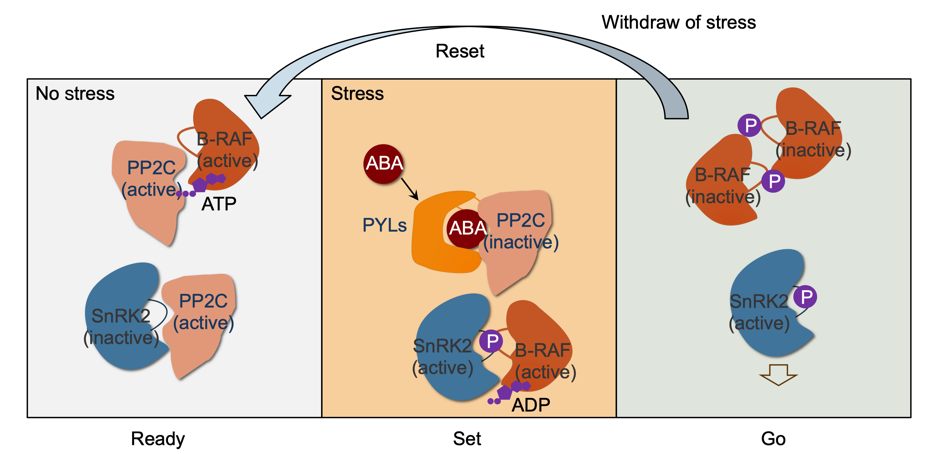
图2 “Ready-Set-Go”机制维持基础 RAF 活性
这一研究揭示了B2/B3 RAF本底激酶活性维持的分子机制,阐明了B2/B3 RAF家族成员ATP结合位点的磷酸化和去磷酸调控激酶活性的巧妙机制,为深入理解RAF蛋白激酶活性和ABA信号途径的调节提供重要线索。值得注意的是,该调控位点在植物B-RAF和哺乳动物b-Raf中高度保守,显示这一磷酸化调控机制可能是RAF家族激酶或其他蛋白激酶活性调控的普遍模式。
王鹏程研究组近年来主要聚焦于植物早期渗透胁迫信号转导机制的研究,系统解析了RAF-SnRK2激酶级联途径在渗透胁迫和ABA信号途径中的核心作用(Lin et al., Nat Commun, 2020;Lin et al., Nat Commun, 2021;Du et al., Stress Biol., 2022;Wang et al., J Integr Plant Biol, 2023;Sang et al., Mol Cell Proteomics, 2024; Wang, Curr Biol, 2024;Wang, Trends Plant Sci, 2024;Wang et al., Cell Reports, 2025等)。王鹏程课题组已毕业博士朱晨和研究助理教授桑田博士为该论文的共同第一作者,博士生张臻、王雨蓓博士、蔺祯博士,南方科技大学朱健康教授、郎曌博教授和河南大学王伟教授参与了部分研究,王鹏程教授为论文通讯作者。
论文链接:https://onlinelibrary.wiley.com/doi/10.1111/jipb.70012

